Maxime a réalisé ses recherches dans l’équipe IDeAS du laboratoire Softmat en collaboration avec TBI.
Le 26 octobre, il a soutenu sa thèse intitulée : « Surfaces polymères à activité enzymatique modulable »
L’exploitation de la biomasse végétale, bien que représentant une grande opportunité pour la production de molécules à haute valeur ajoutée ou de biocarburant, est très énergivore et reste très limitée en termes de rendement et de diversité des produits extraits. Pour contourner ces limites, une des possibilités est de s’inspirer de la nature. En effet, certains microorganismes expriment des cocktails complexes au sein de structure protéiques immobilisées à la surface externe de leur membrane, afin de déconstruire cette biomasse et de la métaboliser.
Ce travail de thèse avait pour objectif d’appréhender de manière originale une des questions soulevées lors de ces processus de déconstruction enzymatique d’un substrat complexe et insoluble : comment ces enzymes se comportent à l’interface solide/liquide et comment la proximité spatiale de ces enzymes impacte leur action ?
Pour y répondre, il a développé une approche unique d’immobilisation d’enzymes sur une surface élastomère. Un étirement mécanique de cette surface permet alors de faire varier la densité surfacique en enzyme et donc la distance entre enzymes.
Dans une première partie, il a caractérisé l’ensemble des éléments utilisés dans ce projet. Tout d’abord, les quatre surfaces élastomères, synthétiques ou commerciales, utilisées pour l’immobilisation d’enzyme sont caractérisées à la fois au niveau moléculaire mais aussi au niveau de leur état de surface. Ensuite l’enzyme en question, une xylanase, est immobilisée sur les élastomères via un couple de protéines Jo et In, autorisant une immobilisation orientée et covalente. Il s’agit alors de s’assurer de l’activité de nos enzymes immobilisées.
Une seconde partie de la thèse se focalise sur la fonctionnalisation des surfaces étudiée. Il est dans un premier temps mis en évidence que cette fonctionnalisation est nécessaire, puis la méthode appliquée est détaillée. Dans un dernier temps, il indique la méthode de caractérisation développée pour mettre en évidence la fonctionnalisation des différentes surfaces.
La troisième partie de la thèse caractérise le greffage de protéine sur nos surfaces élastomères. Tout d’abord la protéine Jo. Son greffage est mis en place grâce à une réaction de Michael thiol-maléimide. Cette étape a nécessité la mise en œuvre d’un large éventail d’approches complémentaires afin de caractériser finement un processus complexe d’immobilisation d’une faible quantité de protéines en monocouche sur une surface lisse. Ensuite, la xylanase exprimée en fusion avec In, est greffée sur la surface par association covalente du couple Jo/In. Cette étape d’immobilisation est de nouveau caractérisée et une méthode de quantification développée spécifiquement dans ce projet permet alors de quantifier les enzymes immobilisées en surface.
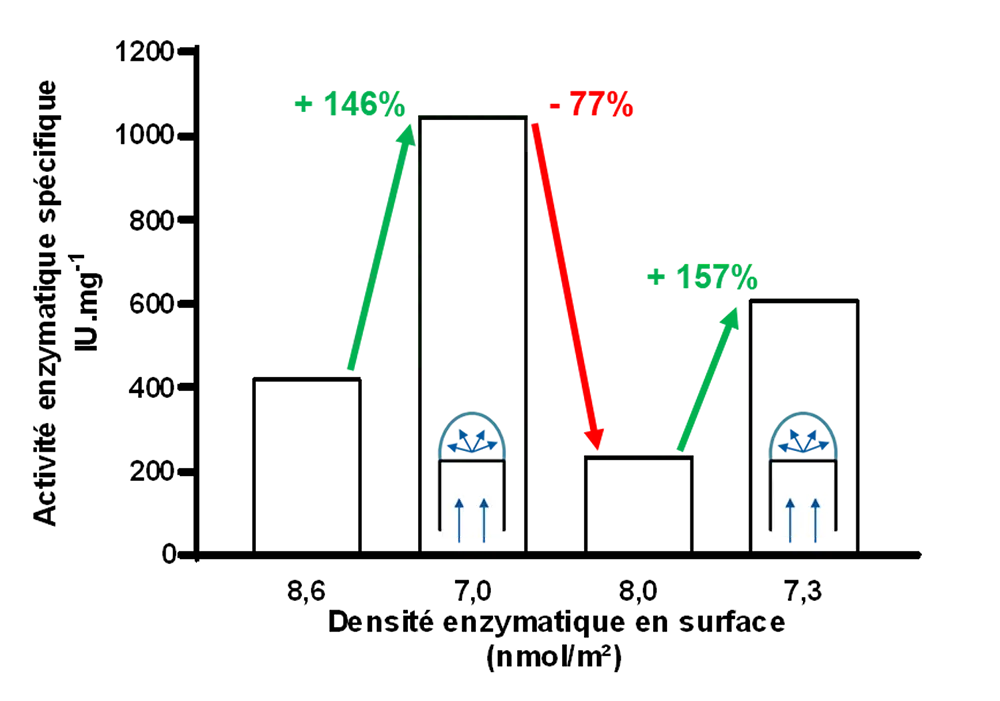
La dernière partie de la thèse permet d’étudier l’effet de la distance entre les enzymes immobilisées sur leur activité spécifique. Les surfaces greffée, disposées sur un outil d’étirement spécifiquement développé au cours de ces travaux, ont été étirées dans des proportions croissantes, augmentant de fait la distance entre les enzymes. Il met en évidence qu’une diminution de la densité des enzymes en surface, et donc une augmentation de la distance entre enzyme entraine une augmentation proportionnée de leur activité spécifique, se rapprochant de celle des enzymes libres en solution.
Il pointe également les contraintes techniques de cette approche et propose quelques solutions de développement afin d’exploiter au mieux le potentiel de cette stratégie.
Faits marquants de la thèse :
- Maxime est co-auteur d’un article publié dans le journal Biotechnology Advance (facteur d’impact = 16).
Félicitations à Maxime pour la qualité de son travail !
